 Химия
Химия (CuOH)2SO4 + 2NaOH = Na2SO4 + 2Cu(OH)2
Na2SO4 + BaX2 = BaSO4↓ + 2NaX
х- отрицательный хлор или гидроксильная группа ОН (отр.)
 Химия
Химия Al(NO3)3 + Na3PO4 = 3NaNO3 + AlPO4 стрелка вниз
2HCl + K2S = 2KCl + H2S стрелка вверх
HCl + KOH = KCl + H2O
 Химия
Химия 1.Ca3N2; CaO; CaF2
2. Li2O; MgO; B2O3; CO2
III I III II IV I I II
3. P H3; Au2O3; Si H4; Ag2O
 Химия
Химия ( C⁺⁴ - окислитель, C⁰ - восстановитель)
2CO + O2 = 2CO2
O₂⁰ + 4 e = 2O⁻² |1
C⁺² - 2e = C⁺⁴ |2
С⁺²- восстановитель, О₂⁰ - окислитель
2Mg + CO2 = 2MgO + C
( C⁺⁴ - окислитель, Mg⁰ - восстановитель)
 Химия
Химия Ca(Oh)2 + 2HCl = CaCl2 + 2H2O
Al(OH)3 + 3HCl = AlCl3 +3H2O
Fe(OH)2 + H2SO4 = FeSO4+2H2O
 Химия
Химия m(Fe) = 20 г
m(S) = 16 г
1 вариант
Fe + 2S = FeS2 (условия: t<700°) образуется пирит(железный колчедан)
n(Fe) = m/M = 20/56 = 0,36 моль
n(S) = m/M = 16/32 = 0,5 моль
по уравнению: 1 моль - 2 моль
по условию: 0,36 моль - 0,5 моль
(избыток)
n(FeS2) = n(S) = 0,5 моль
m(FeS2) = 0,5*120 = 60 г
2 вариант
Fe + S = FeS (условия: t>700°) образуется сульфид железа (II)
n(Fe) = m/M = 20/56 = 0,36 моль
n(S) = m/M = 16/32 = 0,5 моль
по уравнению: 1 моль - 1 моль
по условию: 0,36 моль - 0,5 моль
(избыток)
n(FeS2) = n(S) = 0,36 моль
m(FeS2) = 0,36*120 = 43 г
ответ: 60 г, 43 г; не знаю какое решение верное, так как нет условий реакции
 Химия
Химия 2C4H10 + 13O2 = 8CO2 + 10H2O
CO2 + 2NaOH = Na2CO3 + H2O
n(C4H10) = m/M = 4,4/58 = 0,08 моль
по уравнению: 2 моль(С4Н10) дают 8 моль(СО2)
из условия С4Н10 получилось 0,08 моль, можно составить пропорцию:
2 моль - 8 моль
0,08 моль - х моль
х = 0,08*8/2 = 0,32 моль (то есть 0,08 моль С4Н10 дали 0,32 моль CO2)
n(CO2) = 0,32 моль (эти моли прореагировали со щелочью)
так как отношение СО2 и Na2CO3 один к одному (одинаковые коэффиценты), значит n(Na2CO3) = n(CO2) = 0,32 моль
отсюда находи массу карбоната:
m(Na2CO3) = n*M = 0,32*106 = 33,92 ≈ 34 г
ответ: 34 г
 Химия
Химия H3PO4+3KOH=K3PO4+3H2O
H3PO4+H2SO4≠
2H3PO4+3Na2CO3=2Na3PO4+3CO2↑+3H2O
2H3PO4+3CuO=Cu3(PO4)2+3H2O
2H3PO4+3K2SO3=2K3PO4+3SO2↑+3H2O
H3PO4+SO2≠
 Химия
Химия 8,5 г х г
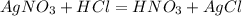
170 г 143,5 г
1. Найдем теоретически возможную массу осадка:
при взаимодействии 170 г нитрата выпадает 143,5 г хлорида, а
при -- // -- 8,5 г_________________х г, откуда
х=8,5*143,5/170=7,18 г
2. Выход продукта - это отношение практической массы продукта реакции(дана по условию задачи и составляет 7 г) к теоретически возможной :
выход продукта=m практическая(AgCl)/m теоретическая(AgCl)=7/7,18=0,97 или 97%
 Химия
Химия 2CH2(OH)-CH(OH)-CH2(OH) + 6Na = 2CH2(ONa)-CH(ONa)-CH2(ONa) + 3H2
n(Na)=15.8/23=0.68696 моль
Количество водорода находим по пропорции 6-3
0,68696-x
x=0.34348
V(H2)=22.4*0.34348=7.693952 л







